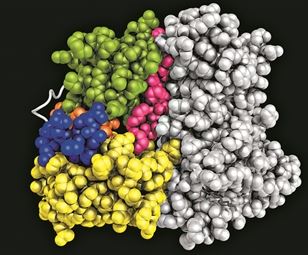
Ενα μακροσκελές άρθρο στο τεύχος της 8ης Οκτωβρίου 2020 του «Science», του πλέον έγκριτου επιστημονικού περιοδικού παγκοσμίως, ήταν αφιερωμένο στη δομή των κινασών, μιας μεγάλης ομάδας πρωτεϊνών οι οποίες εκτελούν πολλούς και ποικίλους ρόλους στα κύτταρά μας και οι οποίες, μέσω αυτών των ρόλων, εξασφαλίζουν την καλή μας υγεία.
Καθώς στην εβδομαδιαία αυτή έκδοση δημοσιεύονται μόνο ιδιαίτερα πρωτότυπες εργασίες, η δημοσίευση ενός άρθρου στο «Science» αποτελεί μεγάλη επαγγελματική επιτυχία για τους ερευνητές, πολλώ δε μάλλον όταν το άρθρο τους εκτείνεται σε 17 σελίδες (πράγμα σπάνιο για την εβδομαδιαία αυτή έκδοση που «προτιμά» μικρής έκτασης άρθρα). Το εν λόγω άρθρο, που από τότε έγινε σημείο αναφοράς στο πεδίο των κινασών, υπογραφόταν από τέσσερις ερευνητές με επικεφαλής τον Ελληνα Χαράλαμπο Καλοδήμο, ο οποίος διευθύνει το Εργαστήριο Δομικής Βιολογίας στο Eρευνητικό Nοσοκομείο Παίδων St. Jude (St. Jude Children’s Research Hospital) στο Μέμφις των ΗΠΑ.

Ο δρ Χαράλαμπος Καλοδήμος στο εργαστήριό του στο νοσοκομείο St. Jude, μπροστά από τον ισχυρό μαγνήτη που χρησιμοποιεί για τη διαλεύκανση της δομής των πρωτεϊνών και την κατανόηση της λειτουργίας τους
Εδώ και καιρό στο ΒΗΜΑ-Science παρακολουθούσαμε την ερευνητική δραστηριότητα του δρος Καλοδήμου αλλά η πανδημική συνθήκη δεν ήταν ευνοϊκή για συναντήσεις. Τον γνωρίσαμε εν τέλει κατά τη διάρκεια πρόσφατου ταξιδιού του στην Αθήνα και μιλήσαμε εκτενώς για τη δουλειά του (η οποία περιγράφεται σε ένα πλήθος άρθρων δημοσιευμένων τόσο στο «Science» όσο και σε άλλα περίβλεπτα επιστημονικά περιοδικά), αλλά και για το δυναμικό εργαστήριό του, το οποίο συγκαταλέγεται στα καλύτερα του κόσμου στο πεδίο της Βιολογίας Κυττάρου.
Δυσεπίλυτος γρίφος
Για να αντιληφθεί κανείς τη δυσκολία των ερωτημάτων που καλείται να απαντήσει ο έλληνας ερευνητής και οι συνεργάτες του θα χρησιμοποιήσουμε μια αναλογία. Φανταστείτε λοιπόν ότι σας ζητούν να περάσετε χρωματιστές χάντρες σε μια κλωστή. Οι χάντρες είναι είκοσι διαφορετικών χρωμάτων και το ανοιχτό «κολιέ» που πρέπει να φτιάξετε θα πρέπει να αποτελείται από χίλιες και πλέον χάντρες. Σας δίνονται λεπτομερείς μεν, κωδικοποιημένες δε οδηγίες ως προς τη σειρά με την οποία θα περαστούν οι χάντρες. Είναι βέβαιον ότι με λίγη προσοχή θα πετύχετε το σωστό αποτέλεσμα. Στο κάτω-κάτω αυτό ακριβώς κάνουν με μεγάλη επιτυχία τα τρισεκατομμύρια των κυττάρων μας όταν παράγουν το πλήθος των πρωτεϊνών που απαιτούνται για να διατηρήσουν τη δομή τους και να επιτελέσουν το έργο τους: ακολουθώντας τις κωδικοποιημένες στο DΝΑ πληροφορίες βάζουν στη σωστή σειρά τα είκοσι διαφορετικά αμινοξέα από τα οποία απαρτίζονται όλες οι πρωτεΐνες μας. Στα κύτταρά μας όμως γίνεται και κάτι ακόμη, το οποίο είναι πολύ σπουδαίο. Οι πρωτεΐνες παύουν να είναι γραμμικές και υιοθετούν μια τρισδιάστατη δομή, η οποία είναι σε άμεση συνάρτηση με τη λειτουργικότητά τους.
Επανερχόμενοι λοιπόν στην αναλογία μας, φανταστείτε τώρα ότι πρέπει να μαντέψετε τη διαμόρφωση του υποτιθέμενου κολιέ στον χώρο. Οι επιλογές εδώ είναι αναρίθμητες: μπορείτε να κάνετε φιόγκους, μαιάνδρους, κουβάρια, πλεξούδες, ελατήρια, συνδυασμούς των παραπάνω και ό,τι άλλο σας αρέσει αλλά ποτέ δεν θα ξέρετε τι ακριβώς συμβαίνει στο κύτταρο με το αντίστοιχο πρωτεϊνικό κολιέ. Στην πραγματικότητα, θα μπορούσε κανείς να προσπαθεί μια ολόκληρη ζωή και πάλι να μη φτάσει στη λύση του προβλήματος. Διόλου τυχαία, η δυνατότητα ανεύρεσης της τρισδιάστατης δομής των πρωτεϊνών με βάση την αλληλουχία των αμινοξέων που τις απαρτίζουν θεωρήθηκε ένα από τα μεγαλύτερα επιτεύγματα της τεχνητής νοημοσύνης.
Η σχετικά πρόσφατη αυτή επιτυχία της τεχνητής νοημοσύνης δεν θα ήταν δυνατή αν δεν είχε προηγηθεί επίπονη εργασία επιστημόνων όπως ο Χαράλαμπος Καλοδήμος. Για να μπορέσει ο αλγόριθμος να δώσει σωστά αποτελέσματα θα πρέπει πρώτα να «εκπαιδευτεί» μελετώντας την τρισδιάστατη δομή πρωτεϊνών οι οποίες έχουν απομονωθεί και μελετηθεί με τη βοήθεια εξελιγμένων τεχνικών δομικής βιολογίας. Με άλλα λόγια, ο Καλοδήμος και οι συνάδελφοί του είναι σε θέση να ανακαλύπτουν ποια ακριβώς είναι η διάταξη στον χώρο (ή αλλιώς η τρισδιάστατη δομή) των πρωτεϊνικών κολιέ που τους ενδιαφέρουν και το επιτυγχάνουν αυτό εξετάζοντας έναν-έναν ξεχωριστά τους πυρήνες των ατόμων που απαρτίζουν κάθε χάντρα του!
Ισχυροί μαγνήτες και υπολογιστές
Η τεχνική η οποία αξιοποιείται ονομάζεται φασματοσκοπία πυρηνικού μαγνητικού συντονισμού (Nuclear Magnetic Resonance spectroscopy, NMR) και συνίσταται στον εντοπισμό τοπικών μαγνητικών πεδίων γύρω από πυρήνες ατόμων. Το προς ανάλυση δείγμα (όπως παραδείγματος χάριν το διάλυμα μιας πρωτεΐνης η οποία έχει απομονωθεί σε καθαρή μορφή) τοποθετείται σε ένα μαγνητικό πεδίο το οποίο είναι ιδιαίτερα ισχυρό. Για την ακρίβεια, είναι εκατομμύρια φορές ισχυρότερο του μαγνητικού πεδίου της Γης(!) και παράγεται από ιδιαίτερα ισχυρούς μαγνήτες. Εκεί, οι πυρήνες των ατόμων του διεγείρονται με τη βοήθεια ραδιοκυμάτων και ανταποκρίνονται παράγοντας ένα ηλεκτρομαγνητικό σήμα η συχνότητα του οποίου (στις συγκεκριμένες συνθήκες) είναι χαρακτηριστική και προδίδει την ταυτότητα των ισοτόπων στο δείγμα. Η συλλογή και ανάλυση με τη βοήθεια ηλεκτρονικών υπολογιστών των λαμβανόμενων σημάτων αποκαλύπτει στους ερευνητές τη στερεοδιάταξη των μορίων που μελετούν.
Οπως εξηγεί ο βραβευμένος για την ποιότητα των «εικόνων» των βιολογικών μακρομορίων που λαμβάνει εφαρμόζοντας την NMR έλληνας επιστήμονας, «η τεχνική αυτή μας παρέχει τη δυνατότητα να βλέπουμε με μεγάλη ευκρίνεια τη δομή πρωτεϊνών και συμπλόκων σε βιολογικά διαλύματα, αλλά και το πώς η δομή αλλάζει σε κλάσματα δευτερολέπτου καθώς η πρωτεΐνη δουλεύει. Βλέπουμε δηλαδή σε πραγματικό χρόνο πώς μία πρωτεΐνη χρησιμοποιεί τη δομή της για να φέρει σε πέρας τη φυσιολογική λειτουργία της στο κύτταρο. Αυτό είναι μια πολύτιμη πληροφορία, η οποία στη συνέχεια μας επιτρέπει να μελετήσουμε τον τρόπο με τον οποίο καρκινικοί παράγοντες επηρεάζουν τη δομή της πρωτεΐνης και επάγουν τη δημιουργία όγκων. Τέλος, η λεπτομερής γνώση της μη φυσιολογικής δομής της πρωτεΐνης μάς επιτρέπει να σχεδιάσουμε καλύτερα φάρμακα».
Η οικογένεια των κινασών
Το βιολογικό μακρομόριο που τράβηξε το ενδιαφέρον του δρος Χαράλαμπου Καλοδήμου δεν είναι ένα αλλά μια ολόκληρη οικογένεια. Πρόκειται για τις πρωτεϊνικές κινάσες, «μια από τις μεγαλύτερες και με πληθώρα διαφορετικών ρόλων οικογένειες πρωτεϊνών: τα πεντακόσια και πλέον μέλη αυτής της οικογένειας εμπλέκονται στον κυτταρικό μεταβολισμό, στη ρύθμιση της κυτταρικής διαίρεσης, στη διαφοροποίηση και στην επιβίωση του κυττάρου. Και όπως θα ήταν αναμενόμενο, όταν οι κινάσες δεν λειτουργούν σωστά, εξαιτίας μεταλλάξεων οι οποίες επιδρούν στη δομή τους, εμφανίζονται ασθένειες όπως ο καρκίνος αλλά και φλεγμονώδεις και νευροεκφυλιστικές παθήσεις. Είναι χαρακτηριστικό ότι οι κινάσες αποτελούν τη συχνότερα μεταλλαγμένη περιοχή του γονιδιώματος των καρκινικών όγκων» εξήγησε ο έλληνας ερευνητής.
Περιττό να πούμε ότι οι κινάσες απασχολούν τους ερευνητές εδώ και δεκαετίες. Μάλιστα ένα από τα πρώτα αντικαρκινικά φάρμακα (η δραστική ουσία του οποίου ονομάζεται imatinib) το οποίο έλαβε έγκριση για τη χρόνια μυελογενή λευχαιμία δρα αναστέλλοντας τη δράση μιας μεταλλαγμένης και ως εκ τούτου μόνιμα δραστηριοποιημένης κινάσης. «Το φάρμακο αυτό υπήρξε το πρώτο που απέδειξε ότι μπορούμε να παρέμβουμε αποτελεσματικά στον καρκίνο μέσω των κινασών. Το προσδόκιμο ζωής των ασθενών εκτοξεύθηκε από 5% στο 90% χάρη στο imatinib» σημείωσε ο έλληνας ερευνητής και προσέθεσε: «Ωστόσο, γρήγορα έγινε σαφές ότι ορισμένοι ασθενείς ανέπτυσσαν ανθεκτικότητα στο φάρμακο. Οτι δηλαδή τα καρκινικά κύτταρα έβρισκαν τρόπο να επανενεργοποιήσουν την κινάση».
Με δύο ανενεργές μορφές!
Υπό κανονικές συνθήκες, τα πρωτεϊνικά μόρια με ενζυμικό ρόλο στα κύτταρα ενεργοποιούνται όταν απαιτείται η ενζυμική τους δράση. Οταν δεν απαιτείται βρίσκονται σε ανενεργή μορφή. «Οι μεταπτώσεις από την ανενεργή στην ενεργή μορφή και αντίστροφα είναι ταχύτατες και επιτυγχάνονται με αλλαγές στη στερεοδιάταξη των πρωτεϊνικών μορίων» εξηγεί ο δρ Καλοδήμος, ο οποίος μελέτησε διεξοδικά αυτές τις μεταπτώσεις σε μια κινάση η οποία ονομάζεται Abl κινάση (Abl kinase) και η οποία ίσως είναι η πλέον μελετημένη της οικογένειας των κινασών. Είναι επίσης η κινάση η οποία αναστέλλεται από το imatinib. Προς μεγάλη έκπληξη του ιδίου και των συνεργατών του διαπίστωσαν ότι η Abl κινάση δεν είχε μία αλλά δύο ανενεργές μορφές! Με άλλα λόγια, η Abl κινάση μπορούσε να καθίσταται ανενεργή αλλάζοντας τη στερεοδομή της με δύο διαφορετικούς τρόπους. Κάτι το οποίο δεν είχε παρατηρηθεί ποτέ μέχρι τότε παρά τις 20.000 και πλέον εργασίες που έχουν δημοσιευθεί για τη συγκεκριμένη κινάση στα επιστημονικά έντυπα.
Η ανθεκτικότητα στα φάρμακα
Οπως συμβαίνει συχνά στην επιστήμη, ένα εύρημα γεννά περισσότερες απορίες από όσες λύνει. Το πρώτο εύλογο ερώτημα, το οποίο διερευνά ήδη η ομάδα του δρος Καλοδήμου, είναι αν και οι άλλες κινάσες έχουν περισσότερες της μιας ανενεργές μορφές, και όπως μας αποκάλυψε η απάντηση είναι θετική. Ωστόσο, πιο «καυτό» είναι το ερώτημα της σημασίας της ύπαρξης διαφορετικών ανενεργών μορφών. «Το κύτταρο δεν μπαίνει στον κόπο να δημιουργήσει κάτι αν αυτό δεν του είναι χρήσιμο» λέει ο δρ Καλοδήμος και προσθέτει: «Η λεπτομερής ανάλυση των διαφορετικών μορφών της Abl κινάσης καθώς και η ανάλυση του συμπλόκου της Abl κινάσης με το imatinib μάς έδειξε ότι η μία από τις δύο ανενεργές μορφές δεν ήταν δεκτική στη δέσμευση του φαρμάκου δίνοντας μια εξήγηση για την παρατηρούμενη ανάπτυξη ανθεκτικότητας σε αυτό».
Ελαχιστοποιώντας τις παρενέργειες
Η παραπάνω διαπίστωση ανοίγει πολλές ερευνητικές πίστες τις οποίες σκοπεύουν να ακολουθήσουν ο ελληνας ερευνητής και οι συνεργάτες του, οι οποίοι μάλιστα εξασφάλισαν ειδική χρηματοδότηση για αυτό. «Ενα από τα μεγάλα προβλήματα που αντιμετωπίζουμε με τα αντικαρκινικά φάρμακα είναι οι παρενέργειες. Οι κινάσες μπορεί να είναι πολλές αλλά το δραστικό κέντρο τους, η περιοχή δηλαδή που ευθύνεται για τη δράση τους, είναι συντηρημένη όπως λέμε στη Βιολογία. Δηλαδή όλες οι κινάσες μοιάζουν σε αυτό το σημείο. Διαφέρουν ωστόσο στις υπόλοιπες περιοχές και η ύπαρξη των ανενεργών μορφών μάς δίνει στόχους για την ανάπτυξη φαρμάκων με μεγαλύτερη εξειδίκευση και λιγότερες παρενέργειες».
Με άλλα λόγια, αυτό που προτίθεται να κάνει ο έλληνας ερευνητής είναι μέσω της διεξοδικής ανάλυσης της τρισδιάστατης δομής των κινασών και της σύνδεσης της κάθε δομής με τη λειτουργία τους να εντοπίσει τρόπους φαρμακευτικών παρεμβάσεων που θα είναι αποτελεσματικές μεν, ήπιες δε ως προς τις παρενέργειές τους. Εννοείται ότι θα είμαστε συντονισμένοι για να σας ενημερώνουμε για τις εξελίξεις…
518 κινάσες έχουν εντοπιστεί στο ανθρώπινο γονιδίωμα. 7% των κινασών έχουν μελετηθεί για θεραπευτικούς σκοπούς.
68αναστολείς της δράσης των κινασών έχουν λάβει έγκριση από την Αρχή Τροφίμων και Φαρμάκων (FDA) των ΗΠΑ για χορήγηση σε ασθενείς.
200 αναστολείς της δράσης των κινασών βρίσκονται σε φάση κλινικών δοκιμών για την αντιμετώπιση μιας σειράς ασθενειών.
Οι σπουδές, η καριέρα και οι βραβεύσεις
Ο δρ Χαράλαμπος Καλοδήμος κατέχει από το 2017 την έδρα βασικής έρευνας Josepf Simone στο Νοσοκομείο St. Jude, όπου ηγείται του Τμήματος Δομικής Βιολογίας. Με καταγωγή από τη Μαγνησία, αποφοίτησε από το Τμήμα Χημείας του Πανεπιστημίου Ιωαννίνων. Το 1999 ολοκλήρωσε τη διδακτορική διατριβή του σε συνεργασία με το Πανεπιστήμιο Ιωαννίνων και το Ινστιτούτο Curie στο Παρίσι (Γαλλία) και εργάστηκε ως μεταδιδακτορικός ερευνητής στην Ουτρέχτη (Ολλανδία) πριν περάσει στην άλλη πλευρά του Ατλαντικού το 2004. Ηδη από την Ολλανδία ο δρ Καλοδήμος άρχισε να διερευνά τις δυνατότητες της φασματοσκοπίας πυρηνικού μαγνητικού συντονισμού (Nuclear Magnetic Resonance spectroscopy, NMR) στη διαλεύκανση της δομής βιολογικών μακρομορίων. Το 2016, όταν ήταν διαπρέπων καθηγητής στο Πανεπιστήμιο της Μινεσότα, του απονεμήθηκε το διεθνές βραβείο Raymond and Beverly Sackler για τις Φυσικές Επιστήμες ως αναγνώριση του έργου του. Οπως επισημαίνεται στη σχετική ανακοίνωση, ο δρ Καλοδήμος «πέτυχε να περιγράψει με εξαιρετική λεπτομέρεια τη δομή, τη λειτουργία και τη δυναμική που αναπτύσσεται σε μια σειρά δύσκολων και σημαντικών βιολογικών συστημάτων». Είναι ο μοναδικός που έχει λάβει το βραβείο του καλυτέρου νέου ερευνητή από την Εταιρεία Πρωτεϊνών και την Εταιρεία Βιοφυσικής την ίδια στιγμή.
Από το 2020 είναι εκλεγμένο μέλος της Αμερικανικής Εταιρείας Βιοφυσικής, ενώ το μεγάλο πλήθος των ερευνητικών εργασιών του έχει δημοσιευθεί σε περίβλεπτα επιστημονικά περιοδικά.
Σε αναζήτηση συνεργατών για το project
Οταν ο δρ Καλοδήμος ανέλαβε τα ηνία του εργαστηρίου Δομικής Βιολογίας του Ερευνητικού Νοσοκομείου Παίδων St. Jude, αυτό απαριθμούσε γύρω στα 35 μέλη. Σήμερα ο αριθμός των συνεργατών του ξεπερνά τους 200 και ο στόχος είναι να φτάσουν σύντομα τους 400. Βλέπετε, υπάρχει πολλή δουλειά που πρέπει να γίνει και ένας αρχικός προϋπολογισμός της τάξεως των 150 εκατομμυρίων δολαρίων που θα την υποστηρίξει. Ο προερχόμενος εξ ολοκλήρου από το νοσοκομείο προϋπολογισμός εντάσσεται στην πρωτοβουλία «Γαλανός ουρανός» (Blue Sky Initiative). Σε αυτή εντάσσονται προγράμματα εκτός του αρχικού στρατηγικού σχεδιασμού, από τα οποία αναμένονται οφέλη ικανά να αλλάξουν το πλαίσιο και τα δεδομένα στη θεραπεία του καρκίνου. Το πρόγραμμα του Χαράλαμπου Καλοδήμου ονομάζεται «Seeing the Invisible in Protein Kinases» (Διακρίνοντας το αόρατο στις πρωτεϊνικές κινάσες) και έχει στόχο να αξιοποιήσει τον εξαιρετικό τεχνολογικό εξοπλισμό του St. Jude προκειμένου να μελετηθεί η τρισδιάστατη δομή των κινασών (οι οποίες εμπλέκονται σε πλήθος κυτταρικών διεργασιών) με τελικό στόχο την ανάπτυξη αντικαρκινικών και όχι μόνο φαρμάκων.
Αξίζει να σημειωθεί ότι ο έλληνας ερευνητές αναζητεί συνεργάτες και θα ήταν ευτυχής να καλωσορίσει συμπατριώτες του στο εργαστήριό του, το οποίο όλα δείχνουν ότι αλλάζει δραματικά το πεδίο των κινασών.