Δεκαεπτά προϊόντα, από τα οποία 2 φάρμακα, 7 ιατροτεχνολογικά προϊόντα και 8 διαγνωστικά τεστ ανακλήθηκαν από τον Οργανισμό Τροφίμων και Φαρμάκων των ΗΠΑ (FDA) μέσα σε 7,5 μήνες από την επείγουσα έγκριση χρήσης τους, κυρίως λόγω προβλημάτων στην αποτελεσματικότητα ή την ασφάλειά τους.
Συγκεκριμένα η πρώτη ανάκληση έγινε μέσα στις πρώτες 107 ημέρες από την έγκριση του προϊόντος και η τελευταία στις 429 ημέρες.
Η ίδια διαδικασία όμως, είχε και την θετική της πλευρά, καθώς ένα φάρμακο και ένα εμβόλιο παρουσιάζοντας τα απαραίτητα δεδομένα, έλαβαν πλήρη έγκριση από τον FDA.
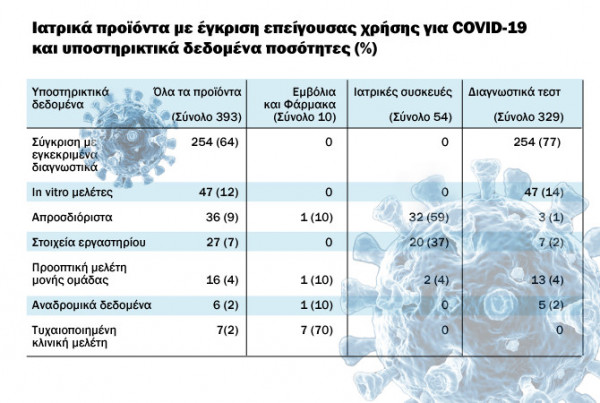
Οι ανακλήσεις αφορούν περίπου το 4% των προϊόντων που έλαβαν επείγουσα άδεια χρήσης λόγω COVID-19 από τον αμερικανικό Οργανισμό, σε σύνολο 393 προϊόντων στα οποία δόθηκε επείγουσα έγκριση. Συνολικά επείγουσα έγκριση δόθηκε σε 329 διαγνωστικά τεστ (ή το 84% όλων των εγκρίσεων), σε 54 ιατροτεχνολογικά προϊόντα (14%) και 10 φάρμακα ή εμβόλια (3%).
Αιτία που οδήγησε στις ανακλήσεις ήταν τα περιορισμένα δεδομένα που κατατέθηκαν αρχικά στο FDA για έγκριση, όμως η ανάγκη για μέσα διάγνωσης του κοροναϊού, οδήγησε στις ταχείες άδειες χρήσης, όχι όμως και σε πλήρη έγκριση.
Το 77% των διαγνωστικών τεστ, δηλαδή τα 254 από τα 329 στήριξαν το αίτημα επείγουσας χρήσης σε συγκρίσεις με αντίστοιχα διαγνωστικά που ήταν ήδη εγκεκριμένα και τα υπόλοιπα 47 (το 14%), κατέθεσαν αποτελέσματα από μελέτες in vitro.
Από τα 54 ιατροτεχνολογικά προϊόντα που πήραν άδεια επείγουσας χρήσης, τα 32 από αυτά (59%), δεν κατέθεσαν συγκεκριμένα αποδεικτικά δεδομένα για τα αποτελέσματα της χρήσης τους, ενώ τα 20 από αυτά ή το 37% των αιτήσεων ιατροτεχνολογικών προϊόντων, παρουσίασαν εργαστηριακά δεδομένα.
Οι επείγουσες άδειες για φάρμακα και εμβόλια υποστηρίχθηκαν κυρίως από τυχαιοποιημένες κλινικές δοκιμές στα 7 από τα 10, με τα 8 από τα 10 φάρμακα να έχουν προηγουμένως εγκριθεί από τον FDA για άλλες ενδείξεις.
Η ταχεία έγκριση
Η διαδικασία παροχής άδειας επείγουσας χρήσης από (FDA) σε φάρμακα, ιατρικές συσκευές και διαγνωστικά μέσα, δίνει τη δυνατότητα αντιμετώπισης καταστάσεων έκτακτης ανάγκης για τη δημόσια υγεία.
Μέχρι πριν 15 χρόνια – οπότε είχε δοθεί άδεια επείγουσας χρήσης για το εμβόλιο κατά του άνθρακα τον Φεβρουάριο του 2005 – ελάχιστα ήταν τα ιατρικά προϊόντα που είχαν εγκριθεί με αυτή τη διαδικασία. Όμως η υγειονομική κρίση από τον κοροναϊό, προκάλεσε εκτεταμένες εγκρίσεις ιατρικών μέσων με τη συγκεκριμένη διαδικασία.
Μελέτη που δημοσιεύθηκε στο JAMA, εξέτασε τα προϊόντα που αξιοποίησαν τη συγκεκριμένη διαδικασία συγκρίνοντας την ποιότητα των υποστηρικτικών στοιχείων που κατατέθηκαν στο FDA για την έγκριση της επείγουσας χρήσης.
Οι ερευνητές Ιτέι Μόσκοβιτς και Ντάνιελ Σεπσέλοβιτς από το τμήμα Γενικής Ιατρικής του Ιατρικού Κέντρου Σουράσκι της Ιατρικής Σχολής του Τελ Αβίβ, συνέλεξαν δεδομένα για τις επείγουσες εγκρίσεις του FDA από την 1η Ιανουαρίου 2020 έως τις 22 Ιανουαρίου 2021. Για τα φάρμακα για τα οποία υπήρχαν κλινικά δεδομένα, τα στοιχεία κατηγοριοποιήθηκαν σύμφωνα με τον υποστηρικτικό σχεδιασμό της κλινικής μελέτης. Για τα διαγνωστικά προϊόντα, καταγράφηκαν συγκρίσεις από προηγούμενες εγκεκριμένες αναλύσεις, αναλυτικές in vitro μελέτες (π.χ. προσδιορισμό ορίων ανιχνευσιμότητας με διαδοχική αραίωση γνωστών δειγμάτων με θετικά αποτελέσματα) ή μη καθορισμένα εργαστηριακά δεδομένα (π.χ. δοκιμές σταθερότητας διαγνωστικού κιτ ).
Ποιότητα των αποδείξεων
Οι περισσότερες επείγουσες άδειες διαγνωστικών τεστ στηρίχθηκαν είτε σε συγκρίσεις με διάφορα τεστ που ήταν ήδη εγκεκριμένα, είτε σε δεδομένα αναλύσεων, όχι κλινικά. Αυτά τα διαγνωστικά προϊόντα δεν ελέγχθηκαν με βάση τις προδιαγραφές κριτηρίων και καμία αξιολόγηση δεν έδειξε ότι τα προϊόντα αυτά εντόπιζαν σωστά τα άτομα με λοίμωξη ή χωρίς. Έτσι, η πραγματική ευαισθησία και ειδικότητα, καθώς και η πραγματική συχνότητα ψευδώς θετικών και ψευδώς αρνητικών αποτελεσμάτων μπορεί να είναι μόνο κατά προσέγγιση.
Οι ερευνητές επισημαίνουν πως «Εξουσιοδοτήσεις που υποστηρίζονται από τόσο χαμηλής ποιότητας δεδομένα είναι λογικές στην αρχή μιας πανδημίας, όταν απαιτούνται επειγόντως διαγνωστικά προϊόντα. Σε μελλοντικές καταστάσεις έκτακτης ανάγκης για τη δημόσια υγεία, όμως, ο FDA θα πρέπει να εξετάσει το ενδεχόμενο να αυξήσει το επίπεδο ποιότητας των αποδεικτικών δεδομένων που απαιτούνται για τις επείγουσες εγκρίσεις, για να διασφαλίσει την ακρίβεια πολλών διαγνωστικών προϊόντων, με την κυκλοφορία τους στην αγορά.
Στις περισσότερες ιατρικές συσκευές χορηγήθηκαν άδειες επείγουσας χρήσης χωρίς τεκμηριωμένα υποστηρικτικά δεδομένα και μόνο ένας μικρός αριθμός υποστηρίχθηκε από κλινικά δεδομένα. Η έλλειψη αποδεικτικών στοιχείων μπορεί να φέρει στην αγορά συσκευές που είναι δυνητικά περισσότερο επιβλαβείς παρά ωφέλιμες. Η ταχεία υιοθέτηση δυνητικά επωφελών τεχνολογιών θα πρέπει να εξισορροπείται με τα ενδεχόμενα προβλήματα ασφάλειας που σχετίζονται με τη συσκευή.
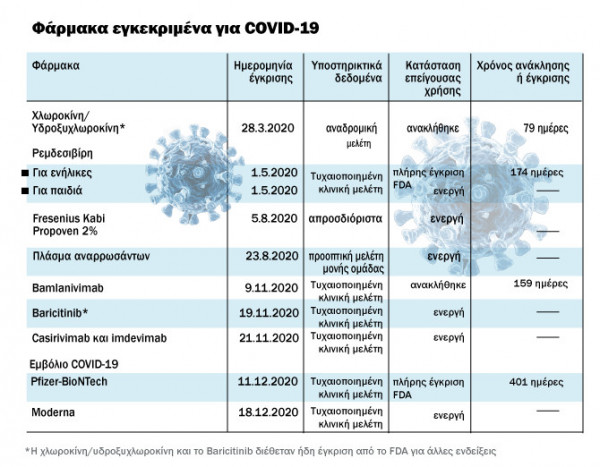
Η άδεια χρήσης χλωροκίνης/υδροξυχλωροκίνης για μόλυνση από COVID-19 υποστηρίχθηκε από αναδρομικά δεδομένα χαμηλής ποιότητας και ανακλήθηκε αμέσως από το FDA.
Οι ερευνητές επισημαίνουν πως οι ρυθμιστικές αρχές θα πρέπει να αντιστέκονται στην πολιτική πίεση να εγκρίνουν προϊόντα που δεν υποστηρίζονται από κλινικά δεδομένα υψηλής ποιότητας. Κάτι τέτοιο μπορεί να αποτρέψει τη σύγχυση και τη δυσπιστία για την ορθότητα της ιατρικής επιστήμης και να ενισχύσει τη φήμη του FDA.
Επισημαίνοντας τους περιορισμούς της μελέτης, οι ερευνητές αναφέρουν την πιθανότητα για ανακριβείς ή ελλιπείς πληροφορίες που αντλήθηκαν από τον ιστότοπο του FDA, καθώς επίσης και το ενδεχόμενο οι αδειοδοτήσεις επείγουσας χρήσης για την COVID-19 να μην αντιπροσωπεύουν την πολιτική εξουσιοδότησης του FDA για άλλες έκτακτες ανάγκες υγείας.
Υπογραμμίζουν όμως πως οι περισσότερες αδειοδοτήσεις επείγουσας χρήσης για COVID-19 δεν υποστηρίζονται από αποδεικτικά στοιχεία υψηλής ποιότητας και εκτιμούν πως τα ευρήματα της μελέτης ενδέχεται να ενημερώσουν τις ρυθμιστικές αρχές για την τρέχουσα κατάσταση των αδειών αυτών, ώστε να συμβάλλουν στις προσπάθειες βελτίωσης των προδιαγραφών.